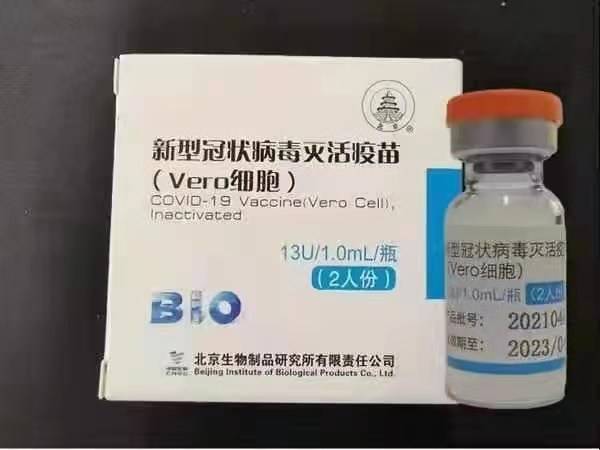
„Sinopharm“ (Pekinas): BBIBP-CorV
FAZĖ 1
1 Bandymas
ChiCTR2000032459
Kinija
2 ETAPA
2 bandymai
NCT04962906
Argentina
ChiCTR2000032459
Kinija
3 ETAPA
6 bandymai
NCT04984408
ChiCTR2000034780
Jungtiniai Arabų Emyratai
NCT04612972
Peru
NCT04510207
Bahreinas, Egiptas, Jordanija, Jungtiniai Arabų Emyratai
NCT04560881, BIBP2020003AR
Argentina
NCT04917523
Jungtiniai Arabų Emyratai
Patvirtinimai
PSO avarinių atvejų sąrašas 59 šalys
Angola, Argentina, Bahreinas, Bangladešas, Baltarusija, Belizas, Bolivija (daugiatautė valstybė), Brazilija, Brunėjus Darusalamas, Kambodža, Kamerūnas, Čadas, Kinija, Komorai, Egiptas, Pusiaujo Gvinėja, Gabonas, Gambija, Gruzija, Gvanaja 、 Iranas (Islamo Respublika), Irakas, Jordanija, Kirgizija, Laoso Liaudies Demokratinė Respublika
Libanas, Malaizija, Maldyvai, Mauritanija, Auritijus, Mongolija, Juodkalnija, Marokas, Mozambikas, Namibija, Nepalas, Nigeris, Šiaurės Makedonija, Pakistanas, Paragvajus, Peru, Filipinai, Kongo Respublika, Enegalas, Serbija, Serbija Salos, Somalis, Šri Lanka, Tailandas, Trinidadas ir Tobagas, Tunisas, Jungtiniai Arabų Emyratai, Venesuela (Bolivaro Respublika), Vietnamas, Zimbabvė
Sinopharm BBIBP-CorV COVID-19 yra inaktyvuota vakcina, pagaminta iš kultivuotų viruso dalelių, kurioms trūksta patogeninių savybių. Šią vakcinos kandidatą sukūrė „Sinopharm Holdings“ ir Pekino biologinių produktų institutas.
Sinopharm BBIBP-CorV vakcina veikia, nes imuninė sistema leidžia gaminti antikūnus prieš SARS-CoV-2 beta koronavirusą. Inaktyvuotos viruso vakcinos buvo naudojamos dešimtmečius, pavyzdžiui, pasiutligės ir hepatito A vakcinos. Ši kūrimo technologija sėkmingai pritaikyta daugeliui gerai žinomų vakcinų, tokių kaip vakcina nuo pasiutligės.
Sinopharm SARS-CoV-2 padermė (WIV04 padermė ir bibliotekos numeris MN996528) buvo išskirtas iš paciento Jinyintano ligoninėje Uhane, Kinijoje. Virusas buvo dauginamas kultūroje kompetentingoje Vero ląstelių linijoje, o užkrėstų ląstelių supernatantas 48 valandas buvo inaktyvuotas β-propiolaktonu (1: 4000 tūrio/tūrio, 2–8 ° C). Išsiaiškinus ląstelių šiukšles ir ultrafiltravus, buvo atliktas antrasis β-propiolaktono inaktyvavimas tomis pačiomis sąlygomis kaip ir pirmoji inaktyvacija. Pasak PSO, vakcina buvo adsorbuota ant 0,5 mg alūno ir įpilama į užpildytus švirkštus 0,5 ml sterilaus fosfatinio buferinio tirpalo be konservantų.
2020 m. Gruodžio 31 d. Valstybinė vaistų administracija paskelbė patvirtinanti „Sinopharm“ sukurtą eksperimentinę vakciną.
2021 m. Gegužės 7 d. Pasaulio sveikatos organizacija paskelbė patvirtinanti vakciną. PSO nepaprastosios padėties sąrašas leido šalims pagreitinti savo reguliavimo leidimus importuoti ir administruoti vakciną nuo COVID-19. PSO patariamoji ekspertų grupė imunizacijos strategijų klausimais taip pat baigė vakcinos peržiūrą. Remdamasi visais turimais įrodymais, PSO rekomenduoja 18 metų ir vyresniems suaugusiesiems skirti dvi vakcinos dozes su trijų ar keturių savaičių pertrauka. Apskaičiuota, kad visų amžiaus grupių vakcinų veiksmingumas prieš simptomines ir hospitalizuotas ligas yra 79%.
2021 m. Gegužės 26 d. Amerikos medicinos asociacija paskelbė „Atsitiktinis klinikinis tyrimas: 2 inaktyvuotų SARS-CoV-2 vakcinų poveikis simptominei COVID-19 infekcijai suaugusiems“, ir padarė išvadą, kad „šioje iš anksto nustatyta atsitiktinių imčių klinikinio tyrimo tarpinėje analizėje, suaugusieji 2 inaktyvuotos SARS-CoV-2 vakcinos, įvestos atliekant šią iš anksto nustatytą tarpinę atsitiktinių imčių klinikinių tyrimų analizę, žymiai sumažino simptominio COVID-19 riziką, o sunkūs nepageidaujami reiškiniai buvo reti. Šio 3 fazės atsitiktinių imčių suaugusiųjų tyrimo metu 2 inaktyvuotų viso viruso vakcinų veiksmingumas simptominiais COVID-19 atvejais buvo atitinkamai 72,8% ir 78,1%. 2 vakcinos turėjo retų sunkių nepageidaujamų reiškinių, kurių dažnis buvo panašus į tik alūno kontrolinę grupę, ir dauguma jų nebuvo susiję su vakcinacija. Tiriamoji analizė parodė, kad 2 vakcinos sukėlė išmatuojamus neutralizuojančius antikūnus, panašius į 1/2 fazės tyrimo rezultatus.
PSO SAGE darbo grupė paskelbė Sinopharm/BBIBP COVID-19 vakcinos apžvalgą 2021 m. Gegužės 10 d. perkaitimas. GAVI pranešė apie žalą, kurią 2021 m. Gegužės 14 d. Pranešė išmaniosios etiketės, pagamintos „Zebra Technologies“ ir pagamintos iš „Temptime Corporation“. . Tai tampa tamsesnė, kad būtų vizualiai parodytas kaupiamasis šilumos poveikis. Kai buteliukas buvo veikiamas karščio, viršijančio optimalų laikymo diapazoną, kvadratas tampa tamsesnis už apskritimą, o tai reiškia, kad vakcinos nebenaudoti.
Nacionalinis vaistų BBIBP-CorV COVID-19 vakcinos vaistų bibliotekos registracijos numeris: DB15807.